La couche d'ozone
Nous entendons parler du trou d'ozone et de ses conséquences dans les médias mais sans en donner beaucoup de détails . Le but de ce cours est de donner une explication précise sur la molécule d'ozone et de son rôle dans le filtrage de nombreux rayons du soleil .
1 ) Généralités
2 ) Rôle de l'ozone dans la gestion des UV
3 ) Photodissociation de l'ozone
4 ) L'ozone en ville
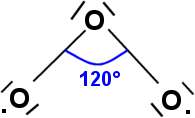
Découvert par le Suisse Schönbein en 1840, l'ozone est une molécule constituée de trois atomes d'oxygene ayant la représentation spatiale suivante :

C'est une molécule qui protège toute vie terrestre des rayons qui lui sont nocifs .
Elle se forme à partir de réaction de photolyse de l'oxygène moléculaire de la manière suivante :
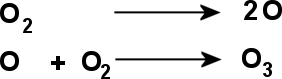
Ces réactions de photolyse de l'oxygène ne se font que par apport d'énergie : les photons .
Les rayons du soleil possèdent une énergie suffisament grande pour casser les molécules de dioxygène et de former des atomes d'oxygène .
La stabilité de l'atome d'oxygène fait qu'il se recombine à un élément autre que l'oxygène : le dioxygène .
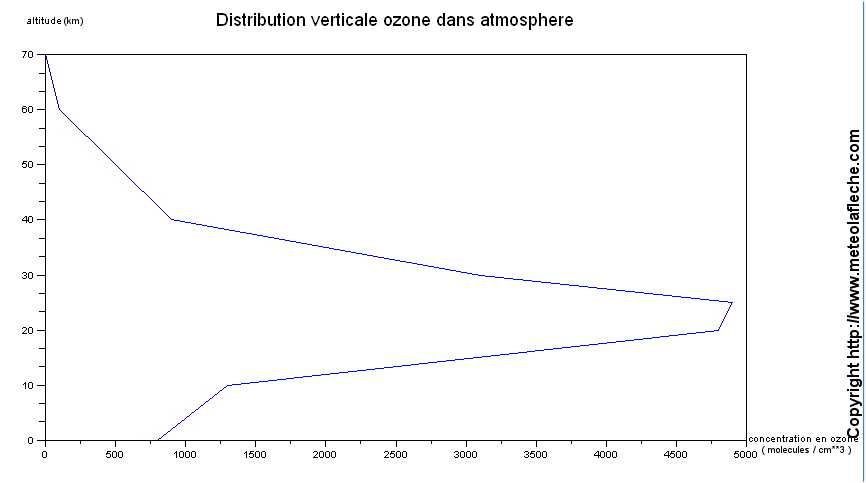
Comme les photos sont nombreux en altitude ( surtout vers 20-25 km ) et que la concentration en oxygène diminue, nous avons une très forte concentration en ozone entre 20 et 25 km d'altitude .
2 ) Rôle de l'ozone dans la gestion des UV
Concrètement, nous pouvons dresser la distribution verticale de l'ozone dans l'atmosphère :
Ce qui donne avec la pression partielle de l'ozone :
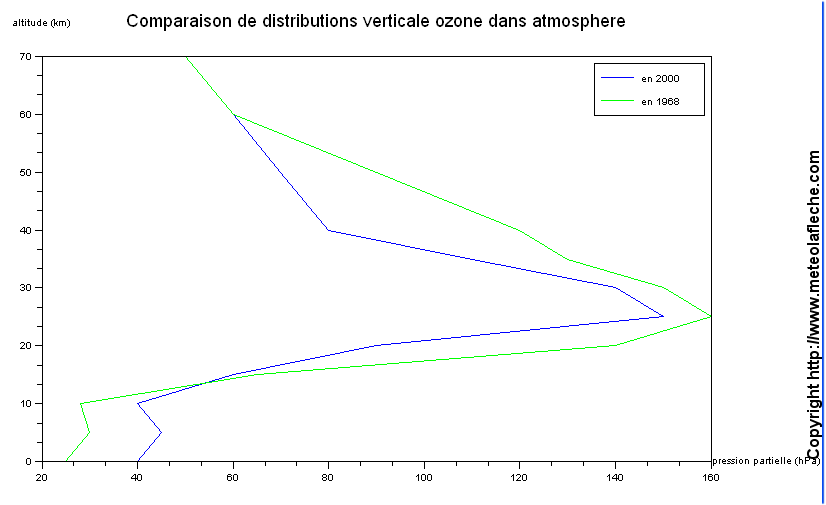
Avec la loi des gaz parfaits PV = nRT, nous avons la possibilité de déterminer l'épaisseur de la couche d'ozone .
La teneur en molécules d'ozone sur 100 km de haut et sur une surface de 1 cm² est aujourd'hui de 9.10^18 molécules, ce qui donne V = 0,35 cm^3 = 3,5.10^-4 L .
D'où l'épaisseur de la couche (valeur virtuelle) : 3,5 mm.
Un chiffre qui peut surprendre mais la configuration spatiale de l'ozone fait que les photons peuvent y être filtrés .
3 ) Photodissociation de l'ozone
L'ozoe peut être détruit par les réactions de catalyse suivante :
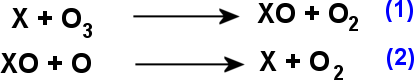
X : catalyseurs .
Les catalyseurs sont les suivants : NO ( dioxyde d'azote ), Cl ( Chlorure ), OH ( hydroxyde ) .
L'enthalpie de la réaction (1) est positive : la réaction (1) ne peut donc se produire spontanément .
Il faut donc un apport d'énergie extérieure pour aboutir à la destruction de l'ozone : une condition réalisée dans les zones de "turbulence" à savoir dans la basse atmosphère ( présence entre autres de chlorofluorocarbones ) .
Une forte concentration en ozone irrite les yeux, la peau, les muqueuses : c'est le cas en ville .
Du NO2 est émis en grande quantité par l'activité humaine favorisant la genèse d'ozone :
![]()
L'oxygène formé se recombine alors avec le dioxygène pour former l'ozone .
Cette dernière réaction étant exothermique, il y a libération de chaleur .
La température de l'atmosphère augmente alors entre 0 et 50 km .
NB : les hydrocarbures issus de volcanismes et de l'activité humaine se dissocient le plus souvent en NO ( qui forme NO2 ) et HO2 qui forment la réaction de photolyse de l'oxygène .
Un fort rayonnement solaire ( été surtout ) favorise donc un pic de pollution .