Les énergies atomiques ( cas du spectre de l'hydrogène )
Beaucoup d'atomes se désexcitent en émettant notamment des ondes électromagnétiques : par exemple, lors d'un orage, de nombreux atomes d'hydrogène sont présents et entrent en intéraction avec les ondes électromagnétiques ; une énorme quantité d'énergie est libérée ( dont nous allons en expliquer la cause ), ce qui favorise de nombreuses décharges électriques .
1 ) Généralités
2 ) Ondes de matière : quantification des énergies atomiques
3 ) Cas du spectre de l'hydrogène
a ) Les sources lumineuses
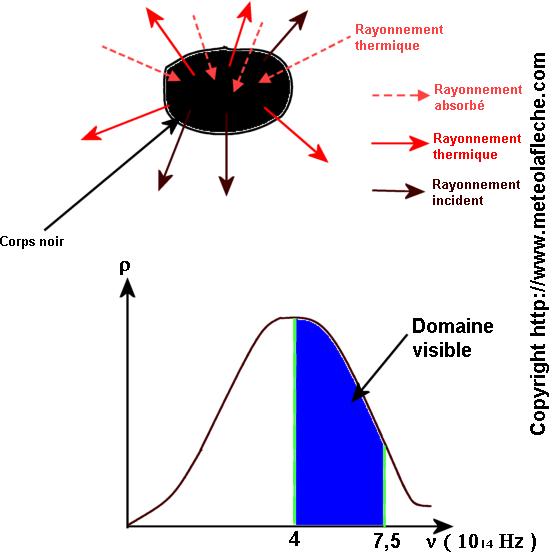
i ) Les sources thermiques ( exemple : corps noir )

ii ) Les décharges électriques
C'est un courant électrique qui traverse des atomes, ce qui provoque un rayonnement où seules les raies réprésentées dans le domaine visible sont visibles .
b ) Loi de combinaison de Ritz
Elle donne une caractéristique de l'atome considéré .
1 / lnm = Tn - Tm
lnm : longueur d'onde caractérisant l'atome considéré .
Tn, Tm : termes spectraux .
Conséquences : nous sommes en présence de plusieurs niveaux d'énergie .
Des "transitions radiatives" sont telles que pour accéder d'un niveau d'énergie supérieur ( noté Em ) à un niveau d'énergie inférieur ( noté En ), un photon peut être émis .
D'où
hnnm = Em - En conservation de l'énergie
h : constante de Planck .
nnm : fréquence du photon émis .
c ) Les raies
Les niveaux d'énergie nous permettent de définir une raie spectrale comme suit :
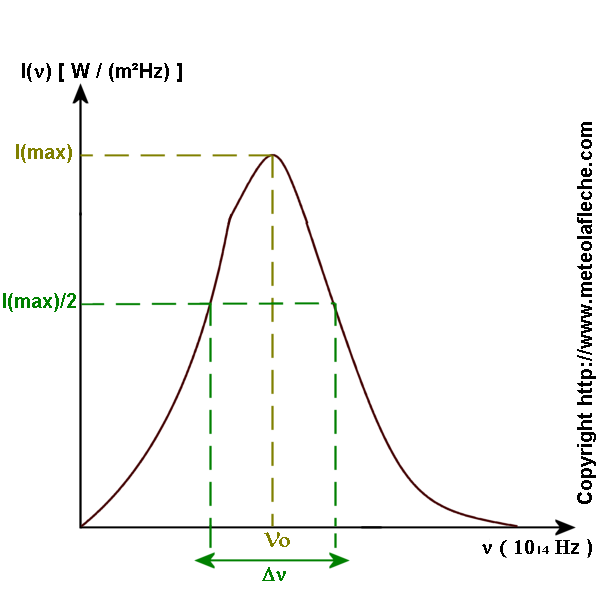
I (n) : intensité spectrale qui est égale à dF / dn ; F : fonction représentant l'intensité de l'onde ( W / m² ) .
Dn : largeur de la raie ( largeur naturelle ) telle que Dn~ 1 / t ; t : temps pendant lequel un atome est dans un état excité .
no : fréquence centrale ( fréquence de la raie ) .
Au niveau des gaz, si nous augmentons la température du système dans lequel se trouve les atomes, alors les raies sont élargies : nous avons la possibilité de démontrer cette propriété par les lois de conservation ( je n'entrerai pas dans les détails ) .
Ce qu'il faut retenir est que nous trouvons n # 0 car l'atome est en mouvement par rapport à un observateur : nous mettons en évidence l'effet Doppler .
Christian Doppler ( 1803-1853 ) : physicien autrichien .
Nous démontrons ainsi que l'allure de la raie observée est d'origine thermique : il y a bien une corrélation entre la température et les gaz à effet de serre émis par l'homme .
d ) Expérience de Franck et Hetz en 1913
James Franck ( 1882-1964 ) : physicien américain natif d'Allemagne ( Prix Nobel de Physique en 1925 ) .
Gustav Hertz ( 1887-1975 ) : physicien allemand ( Prix Nobel de Physique en 1925 ) .
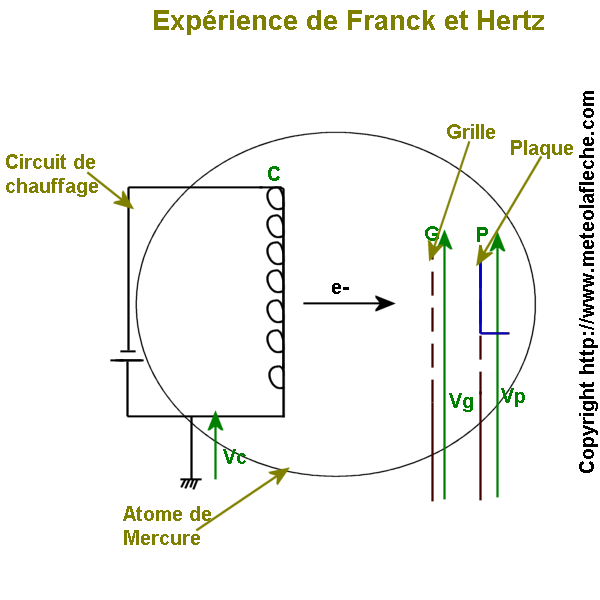
Vc, Vg, Vp potentiels avec Vc = 0 et Vp = Vg - e < Vg ( e constante ) .
Lors du chauffage de l'atome de Mercure, des électrons sont émis . Impulsée par le potentiel Vg, l'énergie cinétique des électrons augmentent jusqu'à ce qu'elle soit supérieure à l'énergie cinétique de l'atome de Mercure .
Entre la grille et la plaque règne un champ électrique ralentissant considérablement la progression des électrons si bien que certains d'entre eux n'atteignent pas la plaque .
L'expérience de Franck et Hertz met en évidence :
-L'existence d'un niveau d'énergie au dessus de l'état fondamental ( Plusieurs niveaux d'énergie en 1920 avec l'expérience de Franck et Einsporn ) .
-Plus les métaux sont chauffés, plus ils sont conducteurs de courant électrique .
2 ) Ondes de matière : quantification des énergies atomiques
Beaucoup de soucis ont marqué la physique atomique notamment dans ses débuts mais aujourd'hui nous arrivons à expliquer comment naissent et se propagent les ondes de matière .
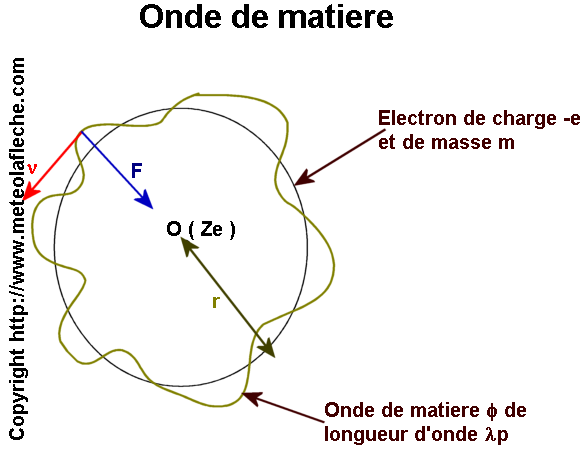
O ( Ze ) : particule de charge Ze immobile au point O .
F : force électrostatique .
n : fréquence de l'électron .
lp : longueur d'onde définie par la relation de De Broglie
lp = h / p
h : constante de Planck .
p : impulsion du photon .
D'où
nl = 2pr avec n entier naturel
Ce qui nous permet de déterminer la quantification des énergies atomiques, il est alors possible d'enrichir en hydrogène par exemple un milieu enrichi d'un autre atome .
Les particules chargées électriquement sont éliminées dans le champ électrique tandis que les particules restent neutres faute d'ionisation .
3 ) Cas du spectre de l'hydrogène
Grace au modèle de Bohr et aux travaux de Balmer et de Rydberg, il a été possible de mettre en évidence une série de raies spectrales de l'atome d'hydrogene .
D'où la relation
1 / lp = Rh ( 1 / n² - 1 /p² ) formule de Rydberg
lp : longueur d'onde de l'atome d'hydrogene .
p : nombre entier supérieur ou égal à 2 .
Rh : constante de Rydberg qui vaut environ 1,1*10**7 m-1 .
n : niveau d'accueil ( premier couche remplie par les électrons ) .
Johannes Robert Rydberg ( 1854-1919 ) : physicien suédois .
Aage Bohr ( 1922- ? ) : physicien danois ( Pix Nobel de Physique en 1975 ) .
Pour n > 2 ou n = 2, les raies se trouvent dans le domaine visible ( 0,4 mm < lp < 0,75 mm ) et dans le domaine ultra violet ( lp < 0,4 mm ) : série de Balmer .
Jakob Balmer ( 1825-1898 ) : physicien suisse .
Pour n =1 ou n > 1, les raies se trouvent dans le domaine ultra violet ( lp < 0,4 mm ) : série de Lyman .